标新生物联合国际团队揭示FER激酶调控头颈鳞癌侵袭新机制,为克服靶向治疗耐药提供新策略
发布日期:2025-10-22 文章来源:标新生物
头颈鳞状细胞癌(HNSCC)是常见的头颈部恶性肿瘤,占比90%。HPV阴性头颈鳞状细胞癌具有高侵袭性,患者术后易局部复发,预后较差。目前针对局部晚期或不可切除肿瘤的靶向治疗局限于单一生长因子受体治疗(如表皮生长因子受体EGFR)。亟需寻找同时抑制多条癌症相关生长因子受体的调控因子,并为改善HNSCC治疗开发新的治疗策略。
标新生物作为共同通讯单位,与荷兰乌得勒支大学医学中心等机构合作,在国际知名期刊《Neoplasia》上发表了题为“FER Kinase governs Invasive Growth of Head and Neck Squamous Cell Carcinoma through dynamic control of Growth Factor Receptor activity”的研究论文。该研究首次揭示非受体酪氨酸激酶FER是调控HNSCC侵袭性生长的核心分子,其通过动态控制多种生长因子受体(如EGFR和MET)的活性,驱动肿瘤的侵袭和转移。FER有望成为治疗HNSCC的潜力靶点。
临床统计研究表明FER在HNSCC组织中高表达,且与患者淋巴结转移及不良预后显著相关。研究人员利用患者来源的肿瘤类器官模型证实FER对于EGFR和MET的激活及其下游MAPK信号通路的传导至关重要。机制研究表明,FER不仅调控生长因子受体在细胞膜上的初始磷酸化激活,还通过影响配体-受体复合物的内吞运输速度,控制其在内体囊泡中的持续信号传导。这种对生长因子受体活性的双重调控,使得FER成为维持HNSCC“癌基因成瘾”及介导靶向治疗耐药的关键节点(图1)。
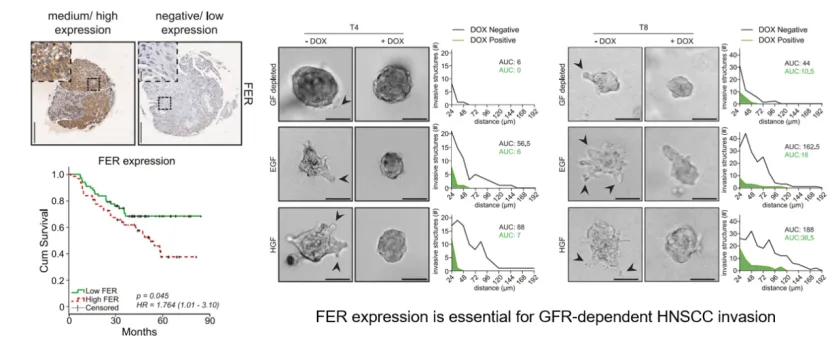
图1. FER在HNSCC高表达,并影响预后;在类器官模型中,knock-down FER可抑制肿瘤细胞的侵袭能力。
为验证FER作为治疗靶点的潜力,研究团队设计合成FER特异性PROTAC降解剂进行靶点评价和药效学研究。在体外类器官模型及体内移植瘤模型中,FER-PROTAC分子能高效降解靶蛋白,显著抑制生长因子诱导的肿瘤细胞侵袭,并有效阻止体内肿瘤的生长。该策略克服了单一靶向EGFR或MET疗效不足的困境,不仅仅为HNSCC靶向治疗转化研究提供了全新的思路和临床前依据,也对其他侵袭性肿瘤的治疗之路提供了宝贵的价值(图 2)。
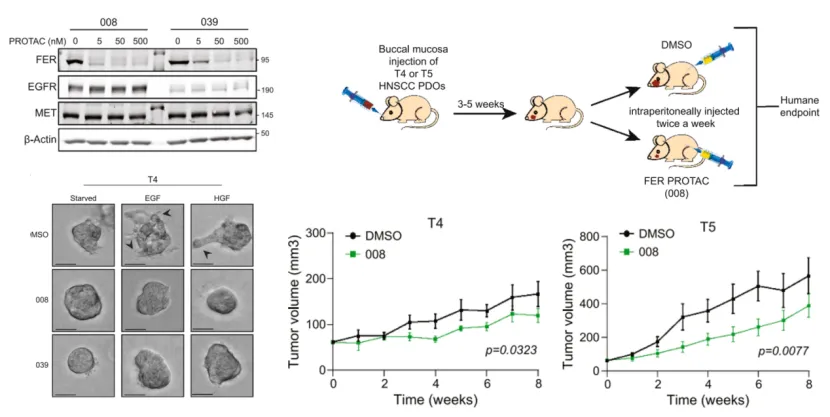
图2. 008和039可显著降解FER;在类器官模型中,008和039均可抑制肿瘤侵袭;008在PDX模型T4和T5中具有有效的抗肿瘤活性。
该研究不仅阐明了FER激酶在驱动HNSCC侵袭中的核心作用及新颖机制,还通过PROTAC技术实现了对FER的靶向降解,证明靶向FER在治疗侵袭性HNSCC方面的巨大潜力。
标新生物作为通讯单位与学术机构合作再发文章,进一步展示了GlueTacs®平台上丰富的技术储备和转化潜力,也体现出该平台重要的学术价值和商业潜力。
论文链接:
https://authors.elsevier.com/sd/article/S1476-5586(25)00121-6